Grâce au glucose, un matériau prolonge la durée de vie de cellules souches
Les cellules souches CSM offrent d’excellentes propriétés régénératrices, mais dépérissent en seulement quelques jours une fois implantées. Des chercheurs et chercheuses du laboratoire de Biologie, bioingénierie et bioimagerie ostéo-articulaires, de l’université de Cergy-Pontoise, du Centre de recherche en neurosciences de Lyon et du Centre de recherche en myologie ont montré que leur mort est due à un manque de glucose, et proposé un système qui maintient les CSM en vie pendant au moins une semaine. Publiés dans la revue Communications Biology, ces travaux contribuent à lever les derniers verrous qui empêchent les CSM d’être employées pour des thérapies cliniques.
Les cellules stromales mésenchymateuses (CSM) sont un type de cellules souches qui suscitent de grands espoirs pour la médecine régénératrice. Elles sont en effet utilisées dans de nombreux essais thérapeutiques pour leur capacité à proliférer, à se différencier afin de reconstruire un tissu lésé, à favoriser la formation de vaisseaux sanguins et à moduler l’inflammation. Cependant, les CSM périssent en masse seulement quelques jours après leur transplantation in vivo, ce qui empêche de les traduire en de nouvelles pratiques cliniques. Ce problème était jusqu’à présent considéré comme dû à un défaut d’oxygénation. Des chercheurs et chercheuses du laboratoire de Biologie, bioingénierie et bioimagerie ostéo-articulaires (B3OA, CNRS/Inserm/Université Paris Cité), de l’université de Cergy-Pontoise, du Centre de recherche en neurosciences de Lyon (CRNL, CNRS/Inserm/Université Claude Bernard) et du Centre de recherche en myologie (Inserm/Sorbonne Université) ont montré que la mort des CSM était en fait provoquée par le manque de glucose. Cette découverte leur a permis de mettre au point un système qui prolonge leur survie et leur fonctionnalité après implantation in vivo.
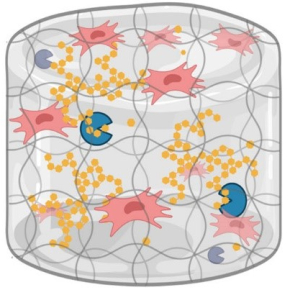
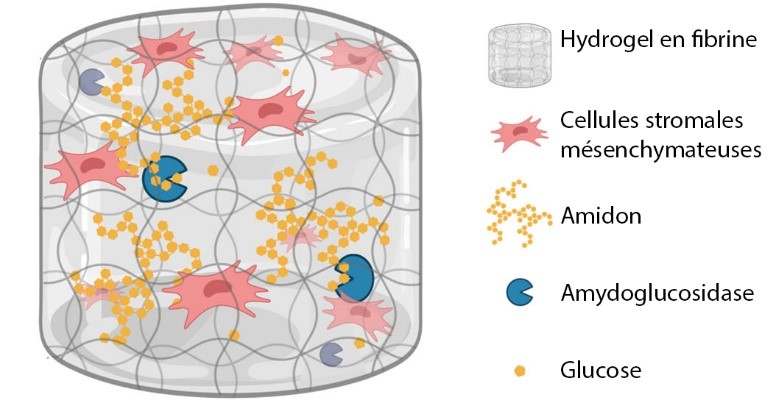
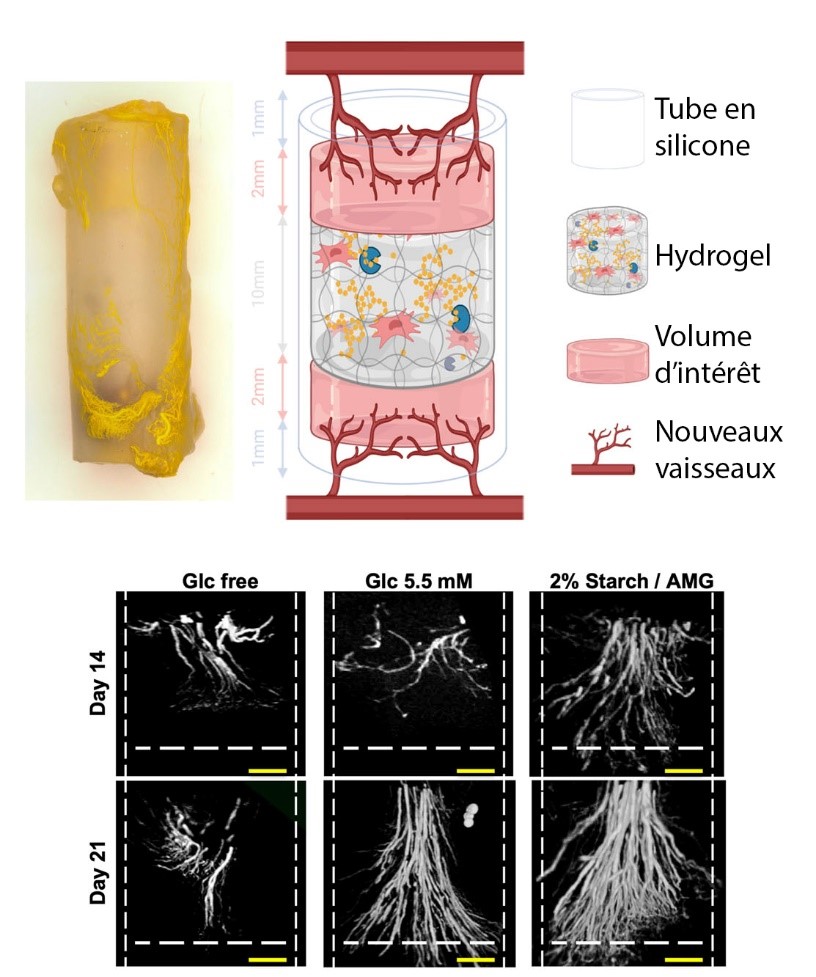
Les équipes ont d’abord mis en évidence la surprenante résistance des CSM aux privations d’oxygène, puis prouvé qu’elles épuisaient à l’inverse rapidement leurs réserves de glucose et d’adénosine triphosphate, une molécule essentielle à tous les êtres vivants et obtenue en dégradant du glucose. Les scientifiques ont ensuite développé un matériau capable de confiner les CSM sur leur site d’implantation et de les y maintenir en vie. Il ne suffit en effet pas d’injecter du glucose, car des concentrations trop élevées sont toxiques pour les cellules. Le matériau conçu est un hydrogel en fibrine, une protéine que l’on retrouve naturellement dans la lymphe et le sang. Le glucose y est stocké sous forme d’amidon, un polymère inerte pour les cellules, que l’enzyme amyloglucosidase (AMG) dégrade de manière contrôlée. Avec ce système, les CSM restent viables pendant une semaine, in vitro comme in vivo, avant de commencer à dépérir. Les chercheurs et chercheuses essayent à présent d’améliorer le matériau pour qu’il offre une meilleure durée de vie. Ces travaux pourraient également être étendus à d’autres cellules utilisées en thérapie cellulaire, notamment dans le cadre de la réparation de tissus ischémiés.
© H. Petite, B3OA
© H. Petite, B3OA
Références
Enzyme-controlled, nutritive hydrogel for mesenchymal stromal cell survival and paracrine functions
Cyprien Denoeud, Guotian Luo, Joseph Paquet, Julie Boisselier, Pauline Wosinski, Adrien Moya, Ahmad Diallo, Nathanael Larochette, Stéphane Marinesco, Anne Meiller, Pierre Becquart, Hilel Moussi, Jean-Thomas Vilquin, Delphine Logeart-Avramoglou, Adeline Gand, Véronique Larreta-Garde, Emmanuel Pauthe, Esther Potier & Hervé Petite.
Communications Biology, volume 6, Article number: 1266 (2023)
https://doi.org/10.1038/s42003-023-05643-y