Contrôler la glycémie pour une meilleure action centrale des signaux métaboliques
Les analogues du Glucagon like peptide 1 (GLP-1 A) font partie de l’arsenal pharmacologique pour lutter contre les maladies métaboliques. Les bénéfices des GLP-1A sont plus marqués chez les personnes dont la glycémie est normalisée. L’étude parue dans la revue Cell Reports apporte un éclairage à ce phénomène en décrivant les mécanismes par lesquels les variations de glucose sanguin contrôlent directement l’entrée des GLP-1 A vers le cerveau ainsi que leur action bénéfique sur le métabolisme des lipides.
L'obésité et ses maladies corollaires, comme le diabète de type 2, les maladies cardiovasculaires, etc. représentent une pandémie mondiale. Une des stratégies pharmacologiques les plus répandues pour le diabète de type 2 repose sur l'administration d'insuline (la seule hormone capable de réguler à la baisse le glucose) et de la nouvelle classe de molécules agonistes du récepteur au Glucagon like peptide 1 (GLP-1 R). Le GPL-1 est libéré par l'intestin lors du bol alimentaire et agit notamment sur le pancréas pour augmenter la libération d'insuline et améliorer ainsi le glucose sanguin. Cependant, les molécules mimétiques du GLP-1 ont aussi la capacité à faire perdre du poids. Cette perte est beaucoup plus marquée chez les personnes dont le diabète a tout d'abord été traité et la glycémie revenue à peu près à la normale.
Cette étude éclaire les mécanismes physiologiques sous-jacents en montrant comment les variations de la glycémie affectent directement l’entrée des GLP-1 dans la zone du cerveau où se trouvent des circuits neuronaux capables de contrôler le métabolisme. Ce travail offre de nouvelles pistes de réflexion pour améliorer le traitement des maladies métaboliques.
A l’aide de modèles murins, les scientifiques montrent que les analogues du GLP-1 actuellement commercialisés conduisent à la perte de poids en agissant au niveau du cerveau et promeuvent le métabolisme des graisses. L'entrée et l'action de ces molécules dans le cerveau sont favorisées quand la glycémie est basse ; à l’inverse, l’entrée dans le cerveau est réduite dans le contexte d’une glycémie haute ou de l’obésité. Ce mécanisme d'entrée dans le cerveau, régulé par la glycémie, est relayé par un type cellulaire précis de la barrière hémato-encéphalique (BHE) appelé tanycyte. Au niveau de l’hypothalamus, les tanycytes répondent aux variations de glucose en libérant du vascular endothelial growth factor A (VEGF-A) qui, en retour, conduit à une modification locale de la BHE, au transport facilité des GLP-1A vers leur cible nerveuse et à une amélioration du métabolisme des lipides.
Enfin, preuve de concept de ce mécanisme, la corrélation entre une baisse de la glycémie et l’amélioration du transport d'insuline dans le cerveau est également observée chez l’homme, suggérant qu’à l’instar des GLP-1 A, l’insuline et peut-être d’autres signaux métaboliques voient leur entrée dans le cerveau contrôlée de façon similaire.
Cette étude décrit un mécanisme original qui affecte probablement beaucoup de signaux circulants contrôlant le métabolisme (insuline, GLP1, leptine, ghréline, nutriments, etc.) et dont l'action au niveau du cerveau est optimale en condition de glycémie normalisée. Ainsi, ce travail présente un mécanisme expliquant l’efficacité accrue des analogues du GLP-1 sur la perte de poids dans un contexte de glycémie contrôlée. D’autre part, cette étude suggère que le contrôle de la glycémie est un préalable pour optimiser l'entrée et l'action de toute molécule qui aurait une cible au niveau du cerveau. Cette découverte permettra ainsi de développer et d'optimiser de nouvelles approches thérapeutiques pour traiter les troubles métaboliques.
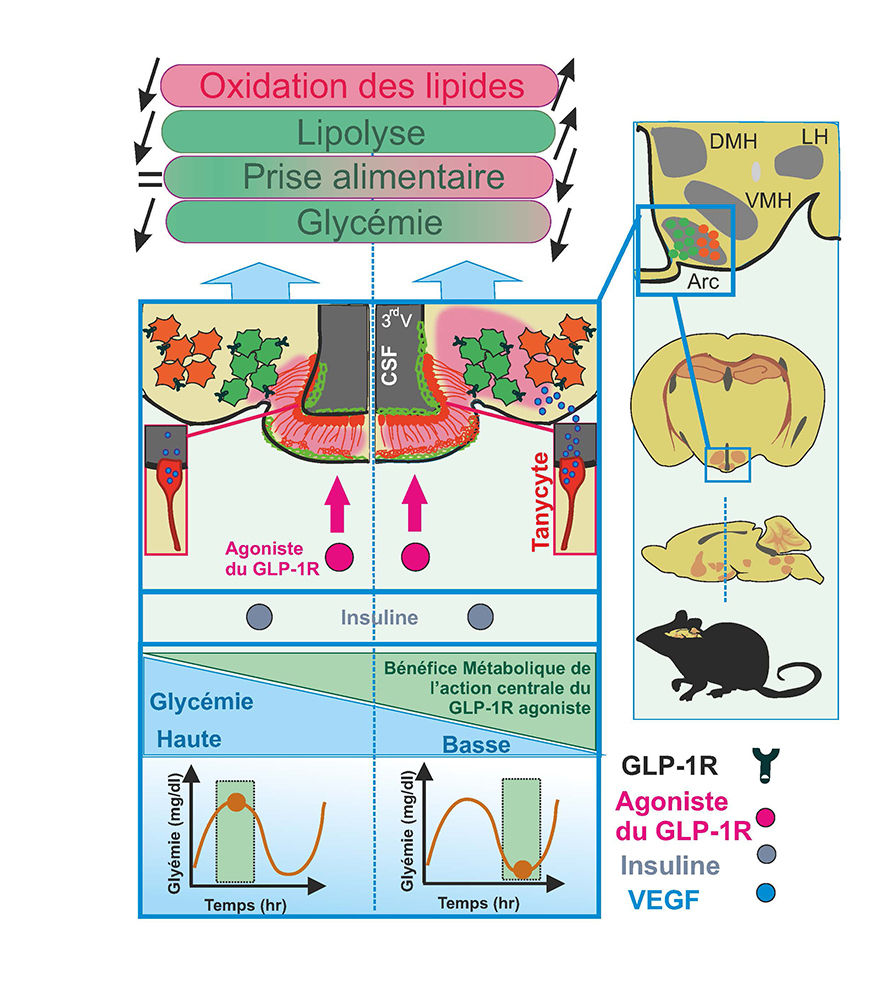
Figure : Les agonistes du récepteur au Glucagon like peptide 1 (GLP-1R) exercent leur action bénéfique sur la glycémie en agissant sur le pancréas notamment mais ils ont aussi une action dans le cerveau sur les circuits neuronaux hypothalamiques de contrôle du métabolisme. Lorsque la glycémie est normale ou basse, l’entrée des GLP-1RA vers les circuits hypothalamiques s’effectue dans une zone du cerveau où la fonction de barrière hémato-encéphalique est contrôlée par des cellules gliales spécialisées appelées tanycytes. La libération de Vascular Endothelial Growth factor A (VEGF-A) par les tanycytes améliore l’accès central des GLP-1RA qui se traduit par une meilleure mobilisation des ressources de graisse. L’hyperglycémie et l’obésité altèrent ce mécanisme et réduisent l’entrée et l’action des GLP-1RA vers leurs cibles centrales.
Pour en savoir plus :
Acute changes in systemic glycaemia gate access and action of GLP-1R agonist on brain structures controlling energy homeostasis.
Wineke Bakker, Monica Imbernon, Casper Gravesen Salinas, Daniela Herrera Moro Chao, Rim Hassouna, Chloe Morel, Claire Martin, Caroline Meresse, Raphael GP Denis, Julien Castel, Andreas Peter, Martin Heni, Walter Maetzler, Heidi Solvang Nielsen, Manon Duquenne, Markus Schwaninger, Sofia Lundh, Wouter Frederic Johan Hogendorf, Giuseppe Gangarossa, Anna Secher, Jacob Hecksher-Sørensen, Thomas Åskov Pedersen, Vincent Prevot, & Serge Luquet.
Cell Reports, 22 novembre 2022. doi: https://doi.org/10.1016/j.celrep.2022.111698