Faire taire les éléments génétiques mobiles dans le génome
Le complexe enzymatique Polycomb Repressive Complex 2 (PRC2) est connu pour son rôle développemental chez les organismes multicellulaires, en agissant sur la chromatine pour maintenir silencieux les gènes qu’il réprime. Cependant, PRC2 peut aussi cibler et réprimer les éléments génétiques mobiles chez divers d’eucaryotes, dont la paramécie. Chez cet organisme, les scientifiques dont des chercheurs de l'Institut Jacques Monod (CNRS / Université paris Cité) et du laboratoire d'épigénétique et destin cellulaire (CNRS / Université Paris Cité) mettent en évidence une interaction physique entre PRC2 et la machinerie de l’ARN interférence qui permet d’expliquer le mécanisme de recrutement de PRC2. Ces résultats, publiés dans la revue Developmental Cell, révèlent un parallèle frappant avec le recrutement d’autres enzymes qui agissent sur la chromatine et répriment aussi les éléments génétiques mobiles.
Chez les eucaryotes, le génome est compacté dans le noyau par des protéines histones. Ces histones peuvent porter des modifications chimiques. La triméthylation de la lysine 27 de l’histone H3 (H3K27me3), par exemple, est catalysée par le complexe enzymatique PRC2 (Polycomb Repressive Complex 2) qui réprime la transcription de certains gènes. Les éléments génétiques mobiles quant à eux sont en général réprimés par la méthylation de l’ADN ou par la méthylation de l’histone H3 au niveau de la lysine 9 (H3K9me). Pourtant, des études récentes montrent que les éléments génétiques mobiles peuvent être ciblés et réprimés par la modification de la lysine 27 (H3K27me3), chez divers eucaryotes dont la paramécie. La manière dont PRC2 est recruté au niveau de ces éléments reste inconnu.
La paramécie est un eucaryote unicellulaire cilié dans lequel une seule enzyme Ezl1, homologue de la sous-unité catalytique de PRC2, catalyse les deux modifications H3K9me3 et H3K27me3 au niveau des transposons, qui sont ensuite éliminés du génome somatique pendant le développement. Les chercheurs ont identifié les protéines qui interagissent physiquement avec Ezl1. En plus d’homologues fonctionnels des sous-unités cœur de PRC2 dans d'autres organismes, plusieurs cofacteurs protéiques supplémentaires ont été identifiés, dont l’effecteur majeur de la machinerie d’ARN interférence, la protéine Piwi qui se lie aux petits ARN. Les scientifiques identifient la protéine qui relie PRC2 et Piwi, déterminant ainsi le mécanisme de recrutement spécifique de PRC2 guidé par les petits ARN. Ce mécanisme de recrutement est similaire à celui décrit pour les enzymes SU(VAR)3-9, qui catalysent au niveau des transposons la modification H3K9me3 dans d’autres organismes.
La répression des transposons chez les eucaryotes implique la mise en place de modifications ciblées des histones guidés par des petits ARN. Au lieu d’utiliser une enzyme qui méthyle H3K9, la paramécie a apparemment connecté la voie de l’ARN interférence avec une enzyme de la machinerie Polycomb possédant une double spécificité de substrat.
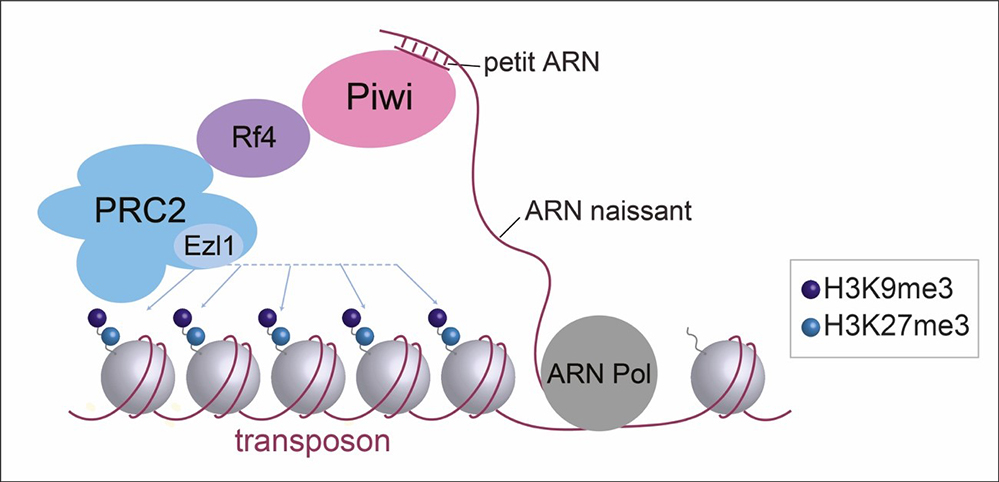
Figure : Le complexe PRC2 interagit physiquement avec la machinerie de l’ARN interférence pour réprimer les éléments transposables chez la paramécie. Le cœur du complexe est constitué de la sous-unité catalytique et de trois autres sous-unités requises pour l’activité catalytique. Les cofacteurs incluent l’effecteur de la machinerie de l’ARN interférence, la protéine Piwi qui lie les petits ARN et la protéine Rf4 qui connecte PCR2 et Piwi, toutes deux nécessaires au ciblage des modifications d’histones (H3K27me3 et H3K9me3) au niveau des transposons.
Pour en savoir plus :
Paramecium Polycomb Repressive Complex 2 physically interacts with the small RNA binding PIWI protein to repress transposable elements.
Miró-Pina C, Charmant O, Kawaguchi T, Holoch D, Michaud A, Cohen I, Humbert A, Jaszczyszyn Y, Chevreux G, Del Maestro L, Ait-Si-Ali S, Arnaiz O, Margueron R, Duharcourt S.
Developmental Cell 15 avril 2022 DOI: https://doi.org/10.1016/j.devcel.2022.03.014