Le rhinovirus humain facilite les surinfections bactériennes en inhibant leur élimination
Chez les patients atteints de maladies pulmonaires chroniques, les infections par les rhinovirus humains, responsables du rhume, peuvent entraîner des surinfections bactériennes. Dans un article publié dans le journal EMBO Reports, les scientifiques montrent que le rhinovirus humain bloque la capacité des macrophages à éliminer les bactéries en augmentant la protéine ARL5b, et révèlent le rôle majeur de cette protéine dans la maturation des phagosomes. Par ailleurs, ces travaux mettent en évidence une fonction de restriction de ARL5b sur la production virale, ce qui ouvre des perspectives thérapeutiques.
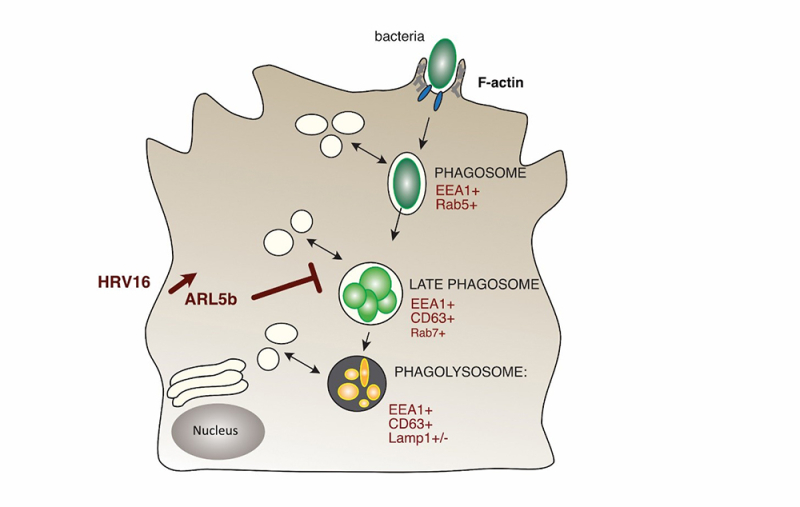
Les rhinovirus humains sont les virus responsables du rhume. Chez les patients atteints de maladies respiratoires chroniques tel que la bronchopneumopathie chronique obstructive, l’infection par les rhinovirus est un facteur de risque majeur d’exacerbations de la maladie. En effet, il est souvent observé que l’infection par le rhinovirus précède une infection secondaire par des bactéries. Il a été montré précédemment que les rhinovirus pouvaient altérer la capacité des macrophages à phagocyter – c’est-à-dire à ingurgiter et digérer- des bactéries, entrainant un défaut de réponse lors d’infections secondaires. Le défaut de capture par les macrophages a été précédemment caractérisé par les auteurs. Cependant, une partie des bactéries est tout de même phagocytée par les macrophages. Il reste donc encore à comprendre si en plus d’un défaut d’ingurgitation, un rhinovirus du groupe majeur, le rhinovirus 16 pourrait causer un défaut de maturation des phagosomes, organites responsables de la digestion des bactéries. En utilisant des macrophages humains primaires, dérivés de monocytes, les auteurs se sont intéressés à l’effet du rhinovirus 16 sur la maturation des phagosomes et sur l’élimination des bactéries phagocytées.
Par des expériences permettant de mesurer la survie intracellulaire des bactéries, ils ont montré que le rhinovirus 16 bloquait la capacité des macrophages à éliminer les bactéries. En effet, ils ont observé une baisse de l’activité des enzymes responsables de la dégradation des bactéries par un processus d’hydrolyse, favorisant leur persistance dans l'organisme.
Le fonctionnement efficace de la phagocytose nécessite un processus complexe de maturation des phagosomes. L’exposition des macrophages au rhinovirus 16 entraîne un délai de maturation des phagosomes précoces et tardifs vers les phagolysosomes dans lesquels les bactéries sont éliminées.
Ces défauts de maturation dans les cellules exposées au virus sont associés à une augmentation de l’expression d’un marqueur associé aux phagosomes précoces (EEA1) et à la relocalisation d’un marqueur associé aux phagosomes tardifs (CD63). Le rhinovirus induit donc une perturbation du trafic intracellulaire, ce qui a été confirmé par l’étude de l’ultrastructure de ces compartiments intracellulaires.
Un premier pas vers des stratégies thérapeutiques visant la réactivation des macrophages
Une analyse de l’expression des gènes a permis d’identifier la protéine ARL5b, une protéine impliquée dans le transport vésiculaire, comme une cible potentielle du virus. Des analyses plus poussées ont confirmé que l’augmentation de l’expression d’ARL5b était responsable des défauts observés, de maturation des phagosomes et d’élimination des bactéries.
Finalement, dans les cellules permissives à la réplication virale du rhinovirus 16, l’expression d’ARL5b est diminuée par l’infection. De plus, la surexpression d’ARL5b entraîne une diminution de l’excrétion des particules virales, permettant donc de conclure qu’ARL5b est un facteur de restriction virale dans les cellules permissives.
Les rhinovirus humains peuvent perturber les fonctions des macrophages, conduisant à un défaut de phagocytose. Ces différentes études ont permis de mettre en évidence que le rhinovirus 16 pouvait inhiber la phagocytose des bactéries par les macrophages à plusieurs niveaux : l’ingurgitation et l’élimination.
Dans le futur, il sera important de comprendre par quel(s) mécanisme(s) le virus augmente l’expression d’ARL5b, quelles voies de signalisation sont activées par le virus dans les macrophages et comment les rhinovirus humains perturbent d’autres fonctions des macrophages telles que la production de médiateurs inflammatoires. Ces études permettent de faire un premier pas vers la mise en place de stratégies thérapeutiques visant la réactivation des fonctions des macrophages.
En savoir plus :
ARL5b inhibits human rhinovirus 16 propagation and impairs macrophage-mediated bacterial clearance Suzanne Faure-Dupuy1,#, Jamil Jubrail1,2,#, Manon Depierre1,§, Kshanti Africano-Gomez1,§, Lisa Öberg3, Elisabeth Israelsson3, Kristofer Thörn3, Cédric Delevoye4,5, Flavia Castellano1,6, Floriane Herit1, Thomas Guilbert1, David G Russell7, Gaell Mayer8, Danen Cunoosamy9, Nisha Kurian9 & Florence Niedergang1. EMBO Rep (2024) https://doi.org/10.1038/s44319-024-00069-x
Laboratoire
Institut Cochin (CNRS/Inserm/Université Paris Cité)
22 rue Méchain,
75014 Paris